दोस्तों आज में आपको रदरफोर्ड का परमाणु मॉडल || Rutherford Ka Parmanu Model के बारे में तथा रदरफोर्ड का परमाणु मॉडल के दोष का सचित्र वर्णन करने वाला हूँ | तो आइये हम आपको rutherford model in hindi के विषय में विस्तार से जानकारी देते हैं |
सन् 1911 में, इंग्लिश भौतिकविद् अर्नेस्ट रदरफोर्ड ने किसी परमाणु में दो मूलभूत कणों इलेक्ट्रॉन तथा प्रोटॉन की स्थिति ज्ञात करने के लिए α – कण प्रकीर्णन प्रयोग ( α -particle scattering experiment) किया।
इस प्रयोग के अन्तर्गत उन्होंने रेडियोऐक्टिव पदार्थ, जैसे— रेडियम को लेड के ब्लॉक के भीतर रखकर प्राप्त ऐल्फा-कणों को एक बारीक लेड की बनी स्लिट से गुजारकर इन्हें पुंज के रूप में प्राप्त किया। इस पुंज को उन्होंने एक भारी धातु; जैसे—गोल्ड की अत्यन्त पतली पन्नी (foil) (100 नैनोमीटर मोटाई) पर डाला।
इससे ये ऐल्फा-कण प्रकीर्णित हो गए, इनकी दिशा ज्ञात करने के लिए उसने जिंक सल्फाइड के लेप किए पर्दे का प्रयोग किया क्योंकि जब कण उससे टकराता है तो यह प्रतिदीप्ति उत्पन्न करता है और उसने देखा कि बहुत से ऐल्फा-कण – पन्नी से पार होकर पीछे लगे जिंक सल्फाइड (ZnS) के पर्दे के मध्य कई स्थानों पर दीप्ति प्रकाश (चमक) उत्पन्न होती है। इस प्रयोग ने इन मूलभूत कणों की परमाणु में स्थिति के निर्धारण में बहुत सहायता प्रदान की। इस प्रयोग को चित्र -‘2.8’ द्वारा दर्शाया गया है।
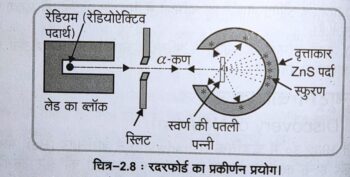
इस प्रयोग द्वारा रदरफोर्ड ने निम्नलिखित प्रेक्षण प्राप्त किए –
(1) अधिकांश अल्फा कण सोने की पत्ती से विक्षेपित हुए बिना निकल गए ।
(2) बहुत कम अल्फा कण छोटे कोण से विक्षेपित हुए।
(3) बहुत ही थोड़े कण (20000 में से 1) पीछे की ओर लौटे अर्थात् लगभग 180° के कोण से उनका विक्षेपण हुआ ।
रदरफोर्ड ने कई प्रयोग करने के पश्चात् निम्नलिखित निष्कर्ष निकाले –
(i) परमाणु के अंदर अधिकांश स्थान रिक्त होता है, क्योंकि अधिकांश अल्फा कण सोने की पन्नी को पार कर जाते हैं।
(ii) कुछ ही धनावेशित α कण विक्षेपित होते हैं। यह विक्षेपण अवश्य ही अत्यधिक प्रतिकर्षण बल (repulsive force) के कारण होगा। इससे यह पता चलता है कि थॉमसन के विचार के विपरीत परमाणु के अंदर धनावेश समान रूप से बँटा हुआ नहीं है। धनावेश बहुत कम आयतन के अंदर संकेंद्रित होना चाहिए, जिससे धनावेशित अल्फा कणों का प्रतिकर्षण और विक्षेपण हुआ हो।
(iii) रदरफोर्ड ने गणना करके दिखाया कि नाभिक का आयतन, परमाणु के कुल आयतन की तुलना में अत्यंत कम (नगण्य) होता है। माणु की त्रिज्या लगभग 10-10m होती है, जबकि नाभिक की त्रिज्या लगभग 10-15m होती है । आकार के इस अंतर का अंदाज इस बात से लगाया जा सकता है कि यदि नाभिक को क्रिकेट की गेंद जितना माना जाए, तो परमाणु की त्रिज्या लगभग 5km होगी।
उपरोक्त प्रेक्षणों और परिणामों के आधार पर रदरफोर्ड परमाणु का नाभिकीय मॉडल या रदरफोर्ड का परमाणु मॉडल प्रस्तुत किया। इस मॉडल के अनुसार –
रदरफोर्ड का परमाणु मॉडल
(i) परमाणु का धनावेश तथा अधिकांश द्रव्यमान एक अति अल्प क्षेत्र में केंद्रित होता है। परमाणु के इस अति अल्प भाग को रदरफोर्ड ने ‘नाभिक‘ कहा।
(ii) नाभिक के चारों ओर इलेक्ट्रॉन वृत्ताकार पथों, जिन्हें कक्षा (orbit) कहा जाता है, में बहुत तेजी से घूमते हैं। अतः रदरफोर्ड का परमाणु मॉडल सौरमंडल से मिलता-जुलता है, जिसमें सूर्य नाभिक के समान होता है और ग्रह गतिमान इलेक्ट्रॉन के समान होते हैं।
(iii) इलेक्ट्रॉन और नाभिक आपस में आकर्षण के स्थिर वैद्युत् बलों के द्वारा बँधे रहते हैं।
इसे भी पढ़ें –
Neutron ki khoj kisne ki||न्यूट्रॉन की खोज किसने की
Class 10 science notes in hindi
Rich Dad Poor Dad in Hindi Pdf | रिच डैड पुअर डैड इन हिंदी पीडीएफ
मेंसुरेशन फार्मूला इन हिंदी |Mensuration Formula in Hindi
रदरफोर्ड का परमाणु मॉडल के दोष
रदरफोर्ड का परमाणु मॉडल की सीमाएँ (अर्थात् दोष या कमियाँ) निम्नलिखित हैं –
(1) रदरफोर्ड के परमाणु मॉडल के अनुसार इलेक्ट्रॉन नाभिक के चारों और विभिन्न कक्षाओं में तीव्र गति से चक्कर लगाते हैं। क्लार्क मैक्सवेल ने बताया कि विद्युत-चुम्बकीय सिद्धान्त के अनुसार, ऋणावेशित इलेक्ट्रॉनों को के धनावेशित नाभिक के चारों ओर चक्कर लगाने के कारण सतत रूप से प्रकाश क विकिरण उत्सर्जित करने चाहिए जिससे लगातार ऊर्जा की क्षति होनी चाहिए नी तथा उनकी कक्षा की त्रिज्या लगातार कम होती जानी चाहिए और अन्त में वे नाभिक में गिरकर नष्ट हो जाने चाहिए। परन्तु ऐसा नहीं होता है क्योंकि परमाणु एक स्थायी निकाय है। अतः रदरफोर्ड मॉडल परमाणु निकाय के स्थायित्व की व्याख्या करने में असफल रहा है ।
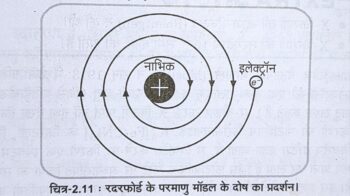
(2) रदरफोर्ड के a-कणों के प्रकीर्णन प्रयोग से परमाणु में उपस्थित प्रोटॉनों तथा इलेक्ट्रॉनों की संख्या के बारे में कोई जानकारी प्राप्त नहीं होती है। अतः यह परमाणु संरचना के बारे में कुछ भी स्पष्ट नहीं करता हैं ।
(3) इस सिद्धान्त के द्वारा यह भी स्पष्ट नहीं होता कि इलेक्ट्रॉन नाभिक के चारों ओर कहाँ और कैसे स्थित रहता है और उसकी ऊर्जा क्या है।
(4) परमाणु रेखीय स्पेक्ट्रम (line spectrum) देते हैं, जबकि यदि • इलेक्ट्रॉन के परिक्रमण से निरन्तर ऊर्जा का उत्सर्जन होता है तो रेखीय स्पेक्ट्रम के स्थान पर सतत स्पेक्ट्रम (continuous spectrum) प्राप्त होना चाहिए था। दूसरे शब्दों में, स्पेक्ट्रम में निश्चित आवृत्ति की रेखाएँ नहीं होनी चाहिए, परन्तु वास्तव में परमाणु का स्पेक्ट्रम सतत नहीं होता। इसके स्पेक्ट्रम में निश्चित आवृत्ति की कई रेखाएँ होती हैं। अतः रदरफोर्ड परमाणु मॉडल परमाणुओं के में रैखिक स्पेक्ट्रम (line spectrum) को समझाने में असफल रहा है।
रदरफोर्ड का परमाणु मॉडल क्या हैं ?
परमाणु का धनावेश तथा अधिकांश द्रव्यमान एक अति अल्प क्षेत्र में केंद्रित होता है। परमाणु के इस अति अल्प भाग को रदरफोर्ड ने नाभिक कहा।
नाभिक के चारों ओर इलेक्ट्रॉन वृत्ताकार पथों, जिन्हें कक्षा (orbit) कहा जाता है, में बहुत तेजी से घूमते हैं। अतः रदरफोर्ड का परमाणु मॉडल सौरमंडल से मिलता-जुलता है, जिसमें सूर्य नाभिक के समान होता है और ग्रह गतिमान इलेक्ट्रॉन के समान होते हैं।
इलेक्ट्रॉन और नाभिक आपस में आकर्षण के स्थिर वैद्युत् बलों के द्वारा बँधे रहते हैं।
रदरफोर्ड का परमाणु मॉडल के दोष क्या हैं ?
रदरफोर्ड के a-कणों के प्रकीर्णन प्रयोग से परमाणु में उपस्थित प्रोटॉनों तथा इलेक्ट्रॉनों की संख्या के बारे में कोई जानकारी प्राप्त नहीं होती है। अतः यह परमाणु संरचना के बारे में कुछ भी स्पष्ट नहीं करता हैं ।
इस सिद्धान्त के द्वारा यह भी स्पष्ट नहीं होता कि इलेक्ट्रॉन नाभिक के चारों ओर कहाँ और कैसे स्थित रहता है और उसकी ऊर्जा क्या है।
